Синтез хлорофилла это многоступенчатый процесс, который делят на две фазы: темновую и световую. В темноте происходит синтез протохлорофиллида, который отличается от хлорофилла отсутствием остатка фитола и двух атомов водорода. Затем на свету протохлорофиллид присоединяет 2 атома водорода к 7-мому и 8-мому углеродным атомам и образует хлорофиллид. К последнему присоединяется фитол, и он превращается в хлорофилл (фермент хлорофиллаза). Эта реакция тоже идет в темноте.
Биосинтез хлорофилла, все ферменты которого локализованы в хлоропластах, подразделяется на следующие этапы:
δ-Аминолевулиновая кислота → Порфобилиноген → Уропорфириноген I и III копропорфиноген III → протопорфиноген IХ → протопорфирин IХ → Mg-протопорфирин IХ метиловый эфир Mg-протопорфирина → протохлорофиллид → протохлорофиллид голохром → хлорофиллид а голохром → хлорофиллид а → хлорофилл.
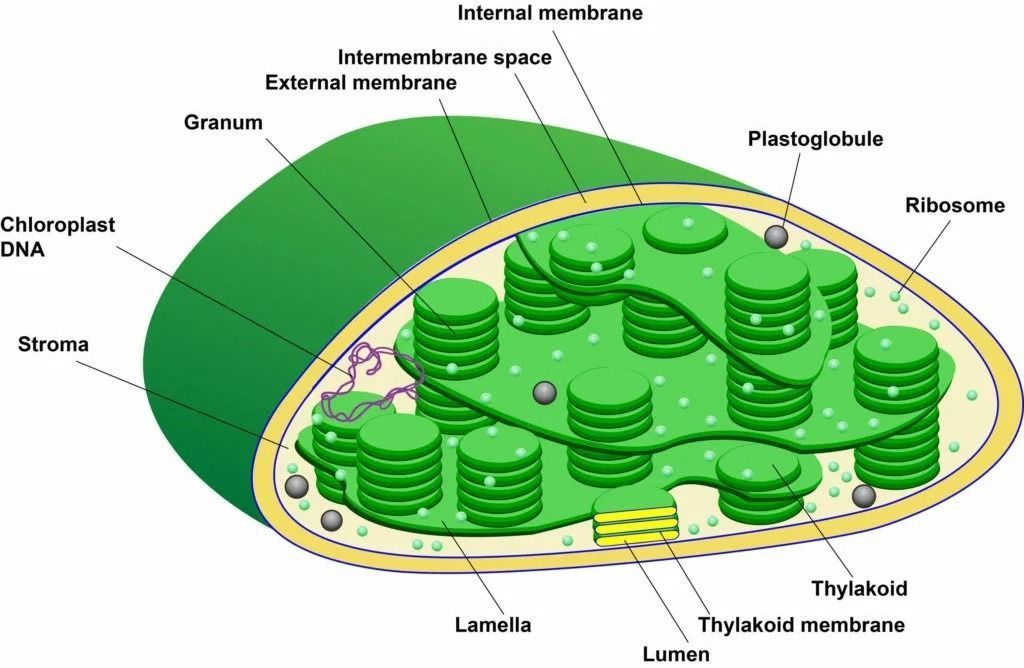
– исходным веществом в биосинтезе порфиринов является сукцинил Со-А (из лимоннокислого цикла) и глицин, из них образуется δ-аминолевулиновая кислота. Этот путь характерен для микроорганизмов и животных. Реакция идет с участием фермента – АЛК-синтаза:
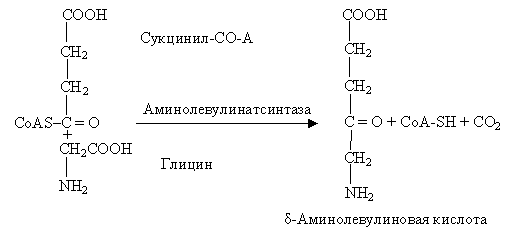
Существует мнение, что АЛК в хлоропластах образуется другим путем, вероятнее всего из интактной молекулы глутамата. Фермент, катализирующий реакцию, удалось выделить из пластид в чистом виде недавно. Реакция представляет собой новый внутримолекулярный перенос аминогруппы:
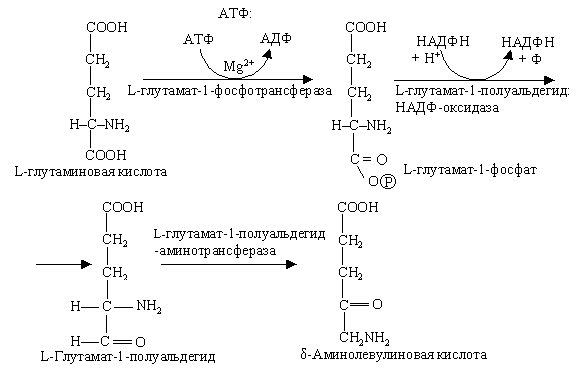
Не так давно уточнили, что δ-аминолевулиновая кислота образуется из С5-дикарбоновых кислот: глутаминовая кислота через 2-гидрооксиглутаровую преобразуется в 4,5-диоксивалериановую, которая затем амминируется за счет аланина и других кислот.
Показательно, что это выраженное разветвление путей биосинтеза гема у животных и высших растений происходит, вероятно, на ключевой стадии биосинтетического пути – образовании АЛК.
Интересно было бы выявить каким из путей синтезируются молекулы АЛК, дающие начало тем небольшим количествам производных гема, которые выявлены у растений, выращенных в темноте: имеет ли место рассмотренный путь синтеза из глутамата или здесь действует путь, который происходит у животных (но его трудно выявить, поскольку в реакциях участвуют очень малые количества субстрата)?
– образование первичного пиррола: 2 молекулы δ-АЛК → порфобилиноген превращаются в присутствии фермента АЛК-дегидратазы. Порфобилиноген – это первый предшественник металлопорфиринов, имеющий пиррольную природу.
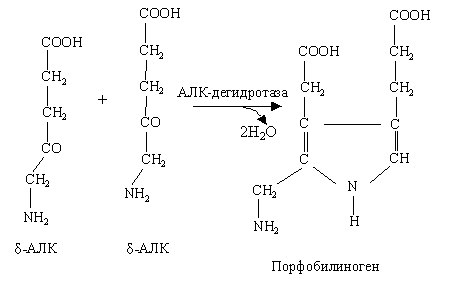
– образование циклического тетрапиррола. Четыре молекулы порфобилиногена превращаются в уропорфиноген I, а затем III:
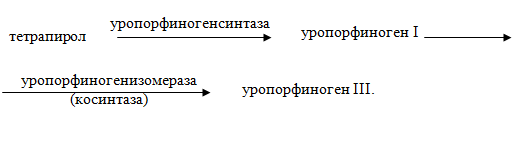
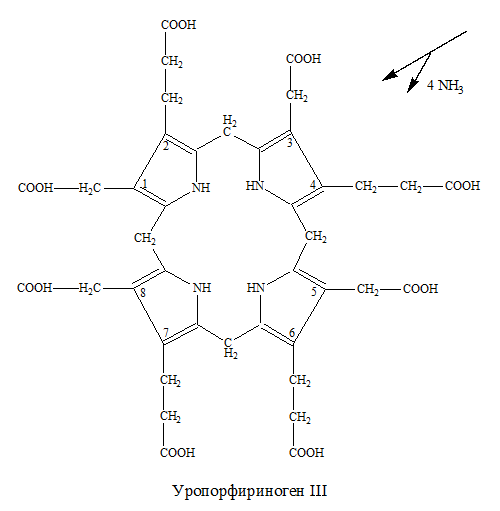
– происходит отщепление 4 СО2от остатков СН2СООН → СН3 в положениях 1, 3, 5, 8 молекулы уропорфириногена с участием фермента уропорфириногендекарбоксилазы и образуется копропорфириноген:
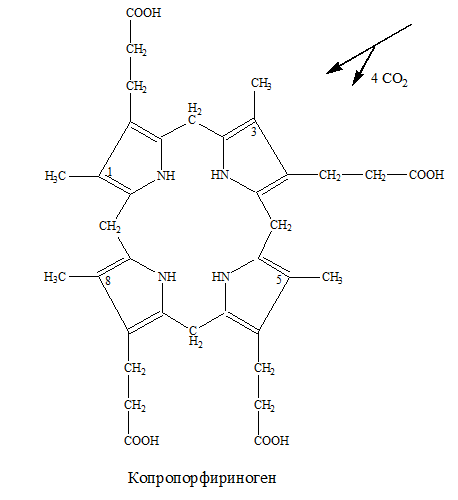
– копропорфиноген превращается в протопорфириноген IХ за счет окислительного декарбоксилирования в 2 и 4 положениях:
–СН2–СН2–СООН + ½ О2→ СН2= СН2+ СО2+ Н2О
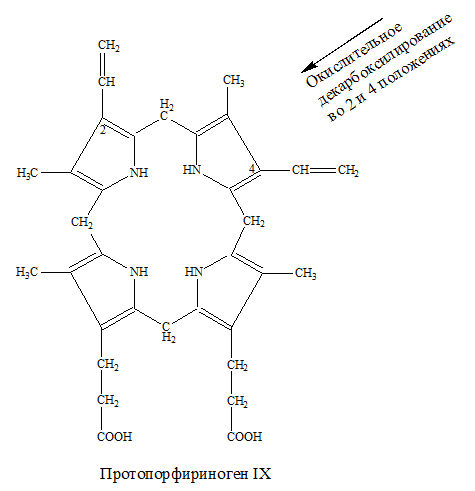
– в результате реакции дегидрирования, при которой отщепляются 6Н+из протопорфириногена IХ образуется протопорфирин:
– происходит включение Mg (NН → N) и образуется Mg-протопорфирин IХ.
Вероятно, на стадии образования протопорфирина IХ происходит также разветвление путей биосинтеза – один ведет к образованию железопорфиринов (гем), другой – к магнийпорфиринов (хлорофиллам). В растениях обнаружены оба пути, у животных – только первый.
В биосинтезе железосодержащих порфиринов участвует фермент феррохелатаза, который выделен как из пластид, так и митохондрий растений. Этот фермент эффективно преобразует протопорфирин в протогем (гемb), который входит в состав цитохромов, каталазы, пероксидазы и гемоглобина. Нужно отметить, что химически встроить Mg2+в протопорфирины намного труднее, чем Fe2+. Какой фермент катализирует включение Mg2+в молекулу протопорфирина пока неизвестно.
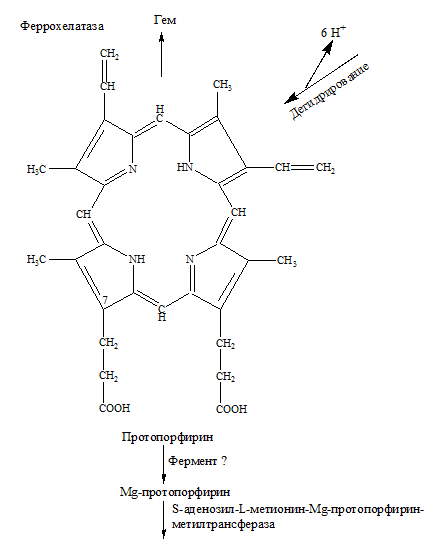
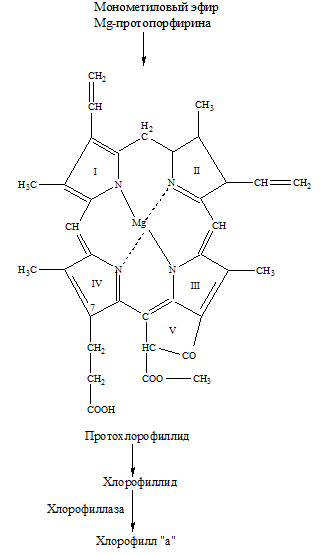
– превращение Mg-протопорфирина IХ в монометиловый эфир Mg-протопорфирина. Происходит этерификация метиловым спиртом. Фермент-S-аденозил-L-метионин-Mg-протопорфирин-метилтрансфераза осуществляет перенос СН3в 6 положение от S-аденозил-L-метионина. Далее, окисление пропионата в положении с образованием группы С=О.
– образование протохлорофиллида происходит в результате этирификации (этирификация – образование сложных эфиров из кислот и спиртов) карбоксильной группы метанолом, замыканием пятого (фуранового) кольца окончательным формированием боковых цепей: в 4 положении винильная группа СН=СН2восстанавливается до этильной группы С2Н5, получается Mg-винилфеопорфирина5-протохлорофилл (ид).
Как и хлорофилл протохлорофиллид находится в связанной с белком форме.
– в результате неферментативной индуцируемой светом реакции восстановления в кольце IV (появляются два атома Н) протохлорофиллид превращается в хлорофиллид (это хлорофиллы, в молекуле которых нет терпеноидной – обычно фитольной – боковой цепи). Спектр действия хлорофиллида подобен спектру поглощения протохлорофиллида, источником водорода в этой реакции служит белок (возможно НАДФ – донор водорода). Выделен в чистом виде фермент НАДФН – протохлорофиллид-оксиредуктаза. Таким образом, восстановление до хлорофиллида катализируется светом и происходит в пигмент-белковом комплексе, который имеет название протохлорофиллид-галохрома.
– последняя стадия синтеза хлорофилла – образование сложного эфира хлорофиллида с фитолом. Которая происходит в липидной фазе хлоропластов, поскольку фитол не растворяется в воде, с участием фермента хлорофиллаза. Фитол – полиизопреновое соединение синтезируется с ацетил-СоА через мевалоновую кислоту.
Хлорофиллbотличается, как мы отмечали от хлорофиллаатолько тем, что боковым заместителем при С3является группа СНО вместо СН3. Соотношение хлорофиллова/bв пределах одного вида – величина довольно постоянная.
Несмотря на большие усилия исследователей, пока никому не удалось детально выяснить, каким путем происходит биосинтез хлорофилла b (его окисление).
Синтез хлорофилла зависит от генетических факторов. В результате генных мутаций появляются растения альбиносы, которые живут пока имеют запасные вещества из семян. Пятнистость – результат отсутствия синтеза хлорофилла в некоторых частях листа, что также зависит от генов.
Содержание хлорофилла в листе колеблется очень мало. Это связано с тем, что старые молекулы пигмента беспрерывно разрушаются и образуются новые. При этом один процесс уравновешивает другой.
Кроме света, синтез хлорофилла зависит и от условий минерального питания. Прежде всего, необходимо железо, которое выполняет каталитические функции. При недостатке железа листья желтеют. Большое значение имеет обеспеченность растений азотом и магнием. Потому что эти элементы входят в состав молекулы пигмента. При нехватке меди хлорофилл легко разрушается.
Этиолированные проростки содержат небольшое количество протохлорофиллид – белкового комплекса (голохром). И при кратковременном освещении в них происходит быстрое стехиометрическое восстановление протохлорофиллида до хлорофиллида, который затем медленно этирифицируется и преобразуется в хлорофилл а. Если проростки затем вновь возвратить в темноту, в них образуется приблизительно такое же количество протохлорофиллида, которое было вначале, и при осветлении он тоже превращается в хлорофиллид. Таким образом, при освещении этиолированных проростков короткими вспышками света (по 10–4с), которые чередуются с 10–15 минутными темновыми промежутками, можно накопить большие количества хлорофилла.
У большинства высших растений синтез хлорофилла происходит только на свету. Хотя у некоторых из них, например, сеянцы хвойных растений, могут синтезировать хлорофилл в темноте. Способны к темновому синтезу хлорофилла и многие водоросли, например бурые и сине-зеленые. Пока что непонятно, почему последняя стадия восстановления пигмента у этих организмов не зависит от освещения (света). Однако показано, что развивающиеся семядоли хвойных синтезируют значительное количество хлорофилла в темноте только до той поры, пока они находятся в контакте с макрогометофитом. Т. е. до того времени пока макрогометофит не исчезнет. Семядоли, которые отделяют от макрогометофита, даже если их поместить в питательный раствор, синтезирует значительно меньше хлорофилла. Следовательно, какое-то вещество из макрогометофита непосредственно участвует в теневом синтезе хлорофилла.
Реакцией, на уровне которой происходит начальный этап биосинтеза хлорофилла, является синтез аминолевулиновой кислоты (рис. 2.6).
АЛК – это субстрат первого основного (решающего) этапа в синтезе тетрапиррола. Это значит, что, вероятно, АЛК лимитирует скорость всего процесса. Об этом свидетельствует и ряд данных. Например, добавление АЛК к этиолированным проросткам в темноте приводит к увеличению количества протохлорофиллида (ПХД). Увеличение происходит в размере около 10-ти раз.
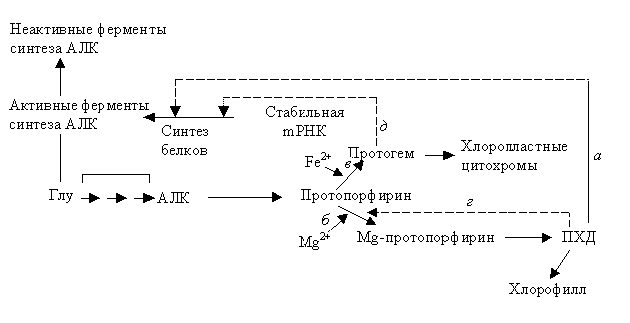
Рис. 2.6.Регуляция биосинтеза порфиринов в развивающихся хлоропластах. Стрелки (![]() ) показывают чем ингибируется процесс
) показывают чем ингибируется процесс
Считается, что протохлорофиллид или другой контролируемый посредник подавляет синтез фермента (или ферментов), действуя на стабильную mРНК.
Поскольку при биосинтезе хлорофилла и биосинтезе гема используется один и тот же накопленный промежуточный продукт, можно принять, что регуляция происходит именно в той точке, где пути биосинтеза расходятся, т. е. на том этапе, на котором атом металла встраивается в молекулу. Вероятно, протохлорофиллид регулирует включение Mg, а так же, как отмечали, синтез белков.
Синтез каротиноидовначинается с ацетил-CоА через мевалоновую кислоту, геранилгеранилпирофосфат до ликопина. Ликопин (С40Н56) – является предшественником всех других каротиноидов. Синтез происходит в темноте и ускоряется при воздействии света. Ликопин имеет ациклическую структуру (отсутствие кольца с двух концов молекулы) и характерен для плодов томата. Циклизация в концах (одного или двух) молекулы ликопина приводит к образованию разных колец (β- и ε-ионовых). Так образование двух β-ионовых колец (по обоим концам молекулы) приводит к образованию β-каротина. Вообще, последовательность превращения каротиноидов следующая:
β-каротин (два β-иононовых кольца) → α-каротин (одно β-, другое ε-иононовое) → лютеин (ε-иононовые кольца и ОН-группа в кольце при С3);
β-каротин → зеаксантин (2 кольца β-иононовые и группа ОН в кольцах) → виолаксантин (два β-иононовых кольца, кроме ОН-групп появляются эпоксигруппы![]() в каждом кольце).
в каждом кольце).
Фотопротекторная роль каротиноидов, т. е. защита хлорофилла от фотоокисления, еще раз подчеркнем, объясняется их способностью взаимодействовать с возбужденными молекулами кислорода и хлорофилла. В этом случае энергия возбуждения триплетного хлорофилла и синглетного кислорода резонансным путем передается на каротиноиды. А затем уже рассеивается в виде тепла.
Таким образом, активный ацетил, образующийся из пировиноградной кислоты, служит исходным веществом для биосинтеза в растениях, сложных соединений к каким относятся и каротиноиды
Предыдущая статья Следующая