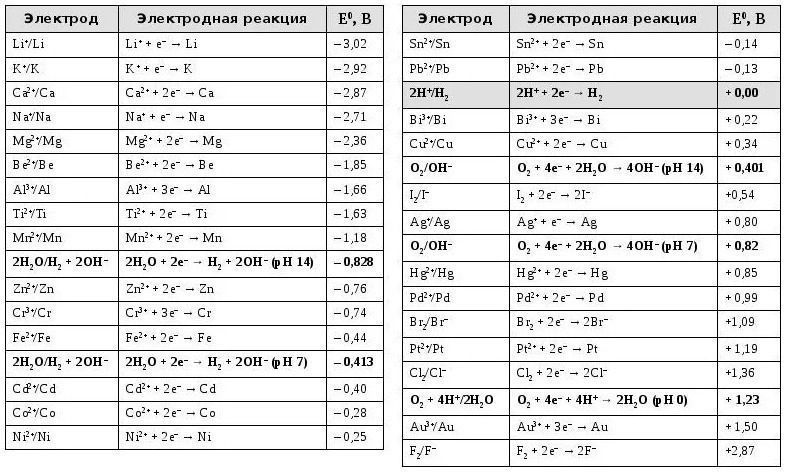
Электро́дный потенциал, это ЭДС химического элемента, составленного из данного электрода и стандартного водородного электрода. Электродный потенциал Водорода принят равным нулю.
Знак электродного потенциала считается положительным, если в гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как “разность потенциалов на границе электрод – раствор”, т.е. считают его тождественным потенциалу ЭДС, что не вполне правильно (хотя эти величины взаимосвязаны).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз. Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Практическое значение имеют относительные электродные потенциалы. Обычно их называют просто электродные потенциалы. Они представляют собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения. Чаще всего электрод сравнения это потенциал водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
Абсолютное значение электродного потенциала непосредственно определить нельзя. Можно измерить лишь разность потенциалов, возникающую между двумя электродами, образующими замкнутую электрическую цепь:
Е = Е2– Е1
В связи с этим для практических целей применяют условную величину, характеризующую потенциал электрода относительно другого электрода взятого за стандарт (электрод сравнения). При этом потенциал электрода сравнения принимают равным 0. Тогда потенциал определяемого электрода будет равен измеренной Е (если Е определяемого электрода > Е электрода сравнения) или –Е (если Е определяемого электрода < Е электрода сравнения).
Обычно в качестве электрода сравнения используют стандартный водородный электрод, потенциал которого принят равным нулю.
Предыдущая статья Следующая